Женщина в результате открытого перелома получила инфекцию бедренной кости и после безуспешной антибиотикотерапии умерла от септического шока. Патогеном оказалась представитель нормальной флоры человека — клебсиелла, устойчивая сразу ко всем 26 антибиотикам зарегистрированным в США.
Ежегодно 23 000 человек в США, 25 000 в Европе и около 700 000 в мире погибает от бактериальных инфекций устойчивых к существующим антибиотикам. Прогнозируется, что через 30 лет смертность от супербактерий достигнет 10 млн. человек в год. На этом фоне сокращаются инвестиции в разработку новых антибиотиков.
Сегодня расскажу о том, почему безобидные бактерии превращаются в агрессивные и устойчивые к лекарствам супербактерии, а разработка новых антибиотиков становится невыгодной.
Случайное открытие антибиотиков
Александр Флеминг знаменит непозволительной для бактериолога неряшливостью. В 1922 году уронив слизь из своего простуженного носа на культуру бактерий он наблюдал лизис колоний и так открыл фермент лизоцим. А в 1928 году случайно занес споры плесени в культуру стафилококка и обнаружил, что вокруг выросшего гриба все бактерии погибли: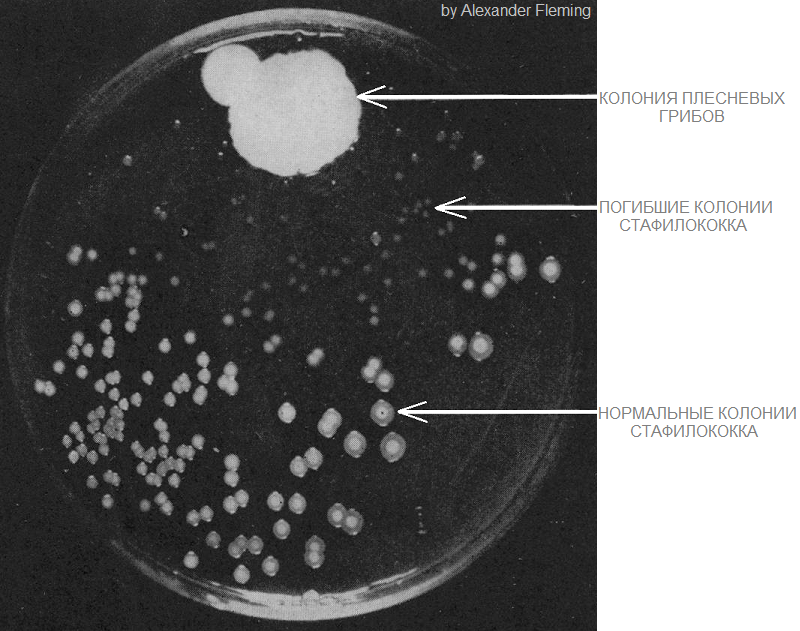
Флеминг догадался, что плесень синтезирует бактерицидное вещество с целью вытеснить конкурирующих за питательный субстрат бактерии. Выделенный из плесени пенициллин оказался эффективнее широко применяемых тогда хирургами наружных антисептиков. В отличие от антисептиков пенициллин можно вводить внутрь организма для борьбы с инфекцией в любых тканях и органах, а антибактериальная активность сохранялась даже после разведения препарата в 800 раз.
Высокая активность мизерных доз позже была объяснена механизмом действия пенициллина. В отличие от антисептиков, которые лишь при высоких концентрациях разрушают клеточную стенку бактерии, пенициллин проникает внутрь клетки и прицельно блокирует синтез биополимера, необходимого для сборки клеточной стенки бактерии.
Антибиотики — биологическое оружие в войне грибов и бактерий
Однако вскоре Флеминг обнаружил, что если применить слишком низкую концентрацию пенициллина или вводить его короткое время, то выжившие колонии бактерий приобретают устойчивость к ранее эффективным дозам препарата. Позднее было установлено, что стафилококки имеют врожденную способность к синтезу фермента разрушающего пенициллин. Это своего рода антидот или противоракетная оборона, где вместо ракет противника — бактерицидное оружие грибов, а вместо противоракет — фермент расщепляющий бактерицид.
Сегодня хорошо известно, что подобные противостояния происходят в природных условиях не только между грибами и бактериями, но даже между близкородственными видами одного рода бактерий. Ведь чем ближе родство, тем более одинакова ниша и субстрат, за которые нужно конкурировать. Например, прямо сейчас разные виды стафилококков ведут непрерывную борьбу за нишу на слизистых вашего рта, одновременно вырабатывая бактерицидные вещества и антидоты. Так что, если вам кажется, что только люди убивают друг друга в борьбе за территорию и ресурсы, посмотрите на этот снимок посева из полости рта здорового человека и представьте, какая резня идет сейчас у вас во рту: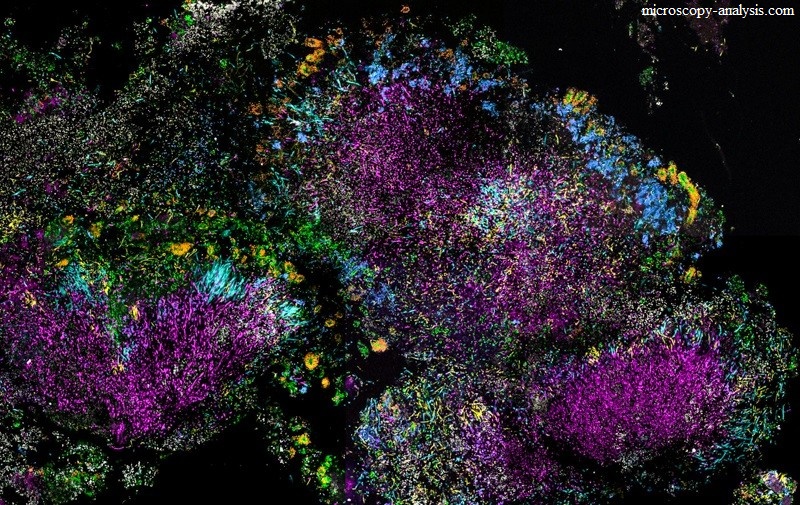
Однако в этой войне нет победителей и проигравших — миллионы лет эволюционного противостояния сотен видов микроорганизмов нашей микрофлоры обернулись балансом, который оказался бесценным приобретением для макроорганизма. Все ниши плотно заселены разношерстной флорой, где поголовье каждого вида строго ограничено бактерицидной активностью соседей, а также размерами ниши и иммунитетом макроорганизма. Например, вызывающий гнойные инфекции Золотистый стафилококк может без вреда для нашего организма иметь популяцию до 10 000 бактерий в мл. среды, а Клебсиелла пневмония, убившая пациентку в США, безобидно присутствует на коже или в кишечнике здорового человека, но не более 10 000 бактерий в грамме фекалий.
Развитие резистентности к антибиотикам
А теперь представьте, что будет, если одной из сторон гражданской войны в маленьком африканском государстве передать оружие массового уничтожения. В случае с бактериями таким оружием будет антибиотик, но не природный, а современный синтетический аналог, применяемый в больших дозах и не локально, а аналогично ковровой бомбардировке — санирующий весь организм целиком.
В результате применения антибиотика видовое разнообразие быстро сократится за счет наиболее чувствительных к препарату видов бактерий. Освободившиеся ниши быстро заселятся видами способными активно синтезировать антидоты. Генетическое разнообразие представителей внутри одного вида тоже уменьшится — эволюционное преимущество получат колонии наиболее устойчивые к антибиотикам. Таким образом применяя антибиотик мы неосознанно создаем положительный отбор наиболее резистентных штаммов. Поэтому бессистемное применение антибиотиков часто заканчивается хроническими инфекциями, обусловленными разрастанием условно-патогенной микрофлоры.
Носитель таких бактерий будет распространять их среди членов семьи, родственников и знакомых, которые рано или поздно применят другие антибиотики, тем самым продолжив положительный естественный отбор, и монорезистентный штамм постепенно приобретет полирезистентность. Такие патогены медики называют супербактериями.
Кроме того разные виды бактерий способны обмениваться между собой генами резистентности к антибиотикам с помощью горизонтального переноса внехромосомных генетических элементов (плазмиды):
Опасно, если полирезистентными к антибиотикам становятся бактерии-анаэробы — способные к бескислородному метаболизму. В случае травмы они могут попасть в кровь и вызвать тяжелый сепсис, как это произошло в описанном выше клиническом случае, когда патоген глубоко проник в костную ткань. Пытаясь спасти женщину, врачи безуспешно применили 14 антибиотиков и еще 12 препаратов протестировали in vitro на культуре выделенной из очага инфекции, но и они оказались неэффективными.
Еще более опасно, когда резистентность приобретают патогенные бактерии, например, возбудители дизентерии, сальмонеллезов и сибирской язвы. Несмотря на низкую распространенность данных инфекций, их возбудители могут легко приобрести резистентность к препаратам от представителей нормальной микрофлоры путем горизонтального переноса генов в составе плазмид. Кроме того часто источником опасных инфекций являются сельскохозяйственные животные, среди которых носительство антибиотикорезистентных бактерий распространено больше, чем среди людей. Это обусловлено тем фактом, что в животноводстве антибиотики пожизненно добавляются в корм с целью профилактики инфекций. Субтерапевтические дозировки не уничтожают бактерии, а лишь сдерживают их размножение. А ведь еще Флеминг предупреждал, что применение низких концентраций антибиотиков ведут к снижению чувствительности бактерий к препарату.
Группа ученых Гарварда поставила интересный эксперимент, наглядно демонстрирующий рост резистентных штаммов при постепенном возрастании концентрации антибиотика от минимальной к 1000-кратной. Очень советую посмотреть короткое видео эксперимента тем, кто самостоятельно принимает антибиотики:
Таким образом важно принимать антибиотик в терапевтических дозах и полным курсом в соответствии с рекомендациями врача.
Метод оценки резистентности к антибиотикам в клинической практике
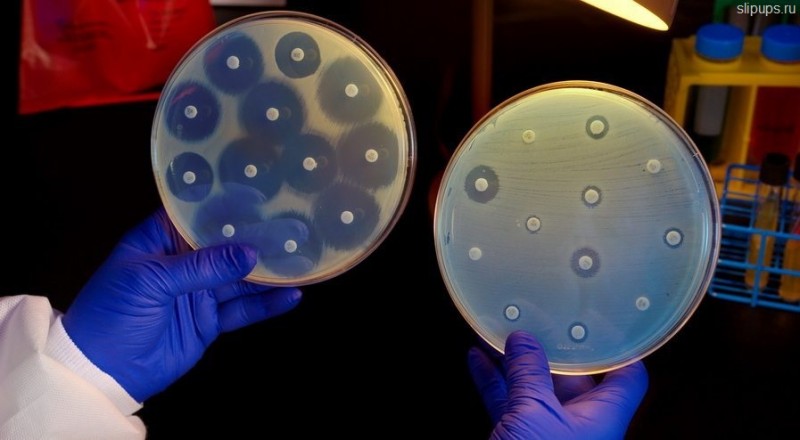
Однако, если вызвавшая заболевание бактерия уже имеет резистентность к препарату, то даже длительный прием антибиотика в высоких дозах может оказаться бесполезным. В таких случаях требуется определение чувствительности патогена к препарату в лаборатории. Для этого на питательную среду одновременно с посевом бактерий укладываются бумажные диски, пропитанные различными антибиотиками. На фото слева — контрольная лабораторная культура (светло-желтая исчерченность на среде), а справа — культура той же бактерии, полученная у пациента из очага инфекции. Прозрачные кольца вокруг дисков означают отсутствие роста бактериальной культуры и, следовательно, ее чувствительность к данному антибиотику. Если же прозрачное кольцо отсутствует, значит к данному антибиотику есть резистентность.
Результаты такого обследования позволят назначить антибиотик узкого спектра действия и прицельно подавить патоген минимизировав ущерб для остальной микрофлоры. Однако выполнение данных анализов — дорогостоящая практика и требует нескольких дней для инкубации. Поэтому, чтобы не терять драгоценное время, врач зачастую назначает антибиотики, не дожидаясь результатов анализа на чувствительность возбудителя к препарату. В подавляющем большинстве случаев данный анализ вовсе не выполняется, а антибиотик назначается даже без выявления вида возбудителя. Такая тактика вынуждает применять антибиотик широкого спектра действия по принципу стрельбы пушкой по воробьям. В частном случае это может быть эффективно как с клинической, так и экономической точек зрения, но в долгосрочной перспективе и в масштабах человеческой популяции данная практика только усугубляет проблему антибиотикорезистентности.
Разработка новых антибиотиков теряет рентабельность
Разработка и испытания новых антибиотиков очень наукоемко и требует около $1 млрд. инвестиций на 10-12 лет до появления препарата в аптеках. При этом антибиотики применяются относительно короткими курсами, часто один или несколько раз за всю жизнь человека. Например, такие группы препаратов, как обезболивающие, жаропонижающие, гормональные — применяются гораздо шире и регулярнее, что делает их более привлекательными для инвесторов. В том числе эти факторы формируют нисходящий тренд внедрения в практику новых антибиотиков:

Дополнительные опасения у инвесторов вызваны распространением бактерий с резистентностью к антибиотикам последних поколений. Современные стандарты терапии вынуждают клиницистов воздержаться от широкого применения новых препаратов и использовать их в крайнем случае в качестве препаратов-резерва, что неизбежно снижает спрос и еще больше замедляет возврат инвестиций. Получается замкнутый круг, когда спровоцированная антибиотиками резистентность бактерий тормозит дальнейшее развитие отрасли в целом.
Заключение
Мой дед Степанов Донат умер от воспаления легких в 26 лет в сибирском поселке Яшкино. Ему не хватило несколько дней, чтобы дождаться своего отца, который вез из Москвы тогда еще дефицитный пенициллин. Спустя 30 лет в той же больнице и от той же болезни пенициллин спас мою недавно начавшуюся жизнь.
Безусловно, открытие и внедрение в терапию антибиотиков совершило переворот в медицине. За 80 лет антибиотикотерапия позволила спасти миллионы жизней и наверняка увеличила среднюю продолжительность жизни человечества. Однако уже сегодня очевидна необходимость поиска новых решений снижающих зависимость медицины от антибиотиков. Я уже писал о пробиотиках, которые можно без вреда для здоровья самостоятельно принимать для профилактики рецидивирующих фарингитов, отитов, тонзиллитов, кариеса и галитоза. Клинические исследования данных препаратов продемонстрировали снижение потребности в антибиотикотерапии. Также можно прочитать мой пост о бактериофагах, которые рассматриваются как альтернатива антибиотикам в борьбе с полирезистентными патогенами.
Несмотря на какие-либо альтернативы не отказывайтесь от приема антибиотиков, назначенных врачом. Если терапия не приносит результатов, требуйте выполнения анализов на выявление возбудителя и определения чувствительности к антибиотику. Кроме того, следует помнить, что подавляющее большинство случаев ОРЗ вызвано вирусами, против которых антибиотики не действуют.
© Андрей Степанов — врач, кмн
Источник